- · 《青岛医药卫生》栏目设[05/19]
- · 《青岛医药卫生》数据库[05/19]
- · 《青岛医药卫生》收稿方[05/19]
- · 《青岛医药卫生》投稿方[05/19]
- · 《青岛医药卫生》征稿要[05/19]
- · 《青岛医药卫生》刊物宗[05/19]
第二批鼓励仿制药品目录已公布!含“罕见药”
作者:网站采编关键词:
摘要:“进口药太贵” “生病吃不起药” “一颗小小的药丸花费数十万” ...... 不论是通过新闻报道、电影渠道 还是自己或身边人的亲身经历 日常生活中 大家对“药价昂贵”的说法都不陌生
“进口药太贵”
“生病吃不起药”
“一颗小小的药丸花费数十万”
......
不论是通过新闻报道、电影渠道
还是自己或身边人的亲身经历
日常生活中
大家对“药价昂贵”的说法都不陌生
不过
今天要给大家带来
一个重磅好消息
↓↓↓
重
磅
关于印发第二批鼓励仿制药品
目录的通知
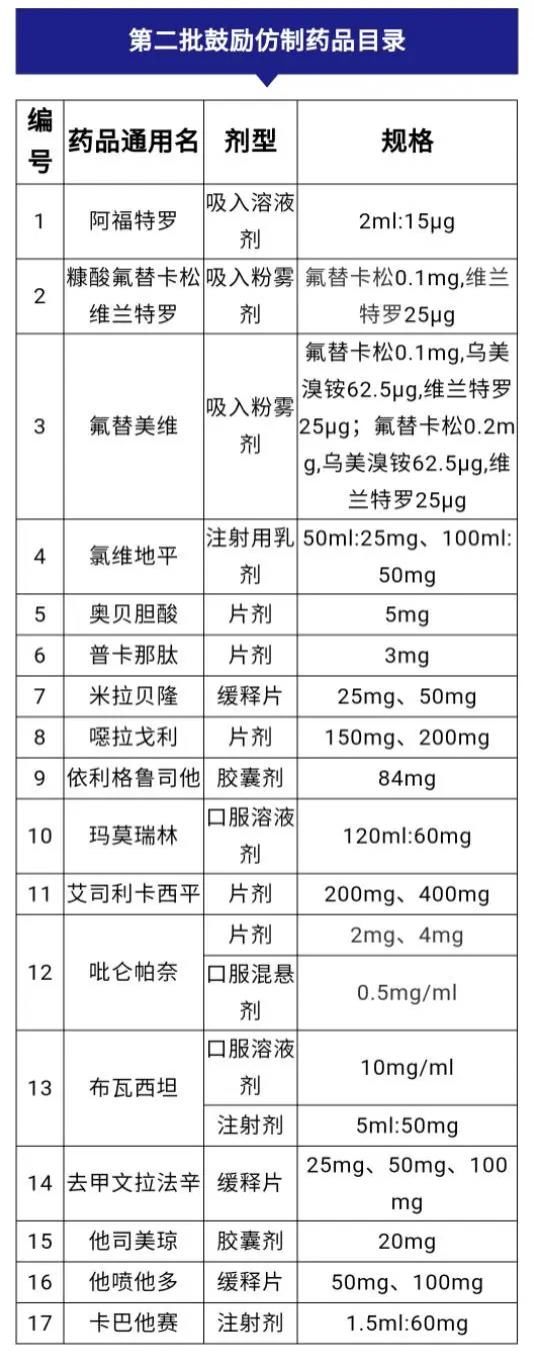
3月15日,国家卫健委、科技部、工信部、国家医保局、国家药监局和国家知识产权局六部门联合印发《第二批鼓励仿制药品目录》(以下简称《目录》),阿福特罗吸入溶液剂等17种药品上榜。
《目录》明确了鼓励仿制的17种药品及剂型,包括阿福特罗吸入溶液剂(规格2ml:15μg)、糠酸氟替卡松维兰特罗吸入粉雾剂(规格氟替卡松0.1mg,维兰特罗25μg)、奥贝胆酸片剂(规格5mg)等。《目录》系相关部门组织专家对国内专利即将到期尚未提出注册申请及临床供应短缺(竞争不充分)的药品进行遴选论证后制定。按照有关规定,《目录》内药品可获得临床试验、关键共性技术研究、优先审评审批等方面的支持。
对已上市药品的仿制是解决我国患者对临床需求领域药品可获得性和可及性的重要手段。近年来,我国鼓励高质量仿制,进一步提高仿制药供应保障能力。
2018年4月,国务院办公厅发布《关于改革完善仿制药供应保障及使用政策的意见》,同年12月,国家卫健委等12部门联合发布《关于加快落实仿制药供应保障及使用政策工作方案》,明确了及时发布鼓励仿制的药品目录、加强仿制药技术攻关、加快提高上市药品质量等七项重点任务。2019年10月,《第一批鼓励仿制药品目录》出台,鼓励波生坦片剂(规格62.5mg、125mg)等33种药品的仿制。2020年7月国务院办公厅印发《深化医药卫生体制改革2020年下半年重点工作任务》,要求制定第二批鼓励仿制药品目录。
此次公布的17种药品明细
大家一起来看看
↓↓↓
 什么是仿制药
什么是仿制药
1、仿制药与原研药的关系
想了解什么是仿制药,就得先了解什么是原研药。
原研药是原创性的新药,需经过对成千上万种化合物层层筛选和严格的临床试验才得以获准上市。平均需要花费15年左右的研发时间和数亿美元,目前只有大型跨国制药企业才有能力研制。
在我国,原研药主要是指过了专利保护期的进口药。
2、仿制药的优势
仿制药是与原研药具有相同的活性成分、剂型、给药途径和治疗作用的替代药品。
它具有降低医疗支出、提高药品可获得性、提升医疗服务水平等重要经济和社会效益。
因此
国家鼓励仿制药生产
对于患者来说,最大的好处
就是可以买到相对便宜的药
不少消费者还会担心
仿制药的安全问题
实际上
国家对仿制药品的监管有着严格规定
一起来看看
↓↓↓
仿制药的监管
2016年
国务院办公厅正式印发了
规定所有仿制药必须进行“一致性评价”
否则不予再注册
1、什么是“一致性评价”
“一致性评价”是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价。
2、主要从以下三个方面确保一致
“药学一致”
活性成分、辅料、剂型及给药途径等方面确保一致
“质量一致”
杂质、含量、稳定性等方面符合相同的质量标准
“生物等效”
生物等效性和临床试验进行验证确保一致
三大环节,环环相扣,切实保障广大人民群众用药安全。特别是2018年11月起,国家“4+7”城市药品集中采购试点工作正式开展,首批正式确定了一批量的通过“一致性评价”的药品品种仿制药纳入采购品种目录范围。
换而言之
仿制药“一致性评价”的实施
能有效保障公众的用药安全
大家大可放心
来源:河北市场监管
文章来源:《青岛医药卫生》 网址: http://www.yywsgw.cn/zonghexinwen/2021/0321/1215.html